O estudo científico "Bridge RNAs direct programmable recombination of target and donor DNA" publicado na revista Nature detalha uma descoberta significativa no campo da biotecnologia, focando em RNAs não codificantes (ncRNAs) que facilitam a recombinação de DNA.
E se tivéssemos a capacidade de recombinar, inserir, excisar ou inverter quaisquer dois pedaços de DNA?
Uma equipe liderada por cientistas do Instituto ARC descobriu que genes saltadores da família IS110 produzem um novo tipo de RNA não codificante que permite rearranjos de DNA totalmente programáveis.
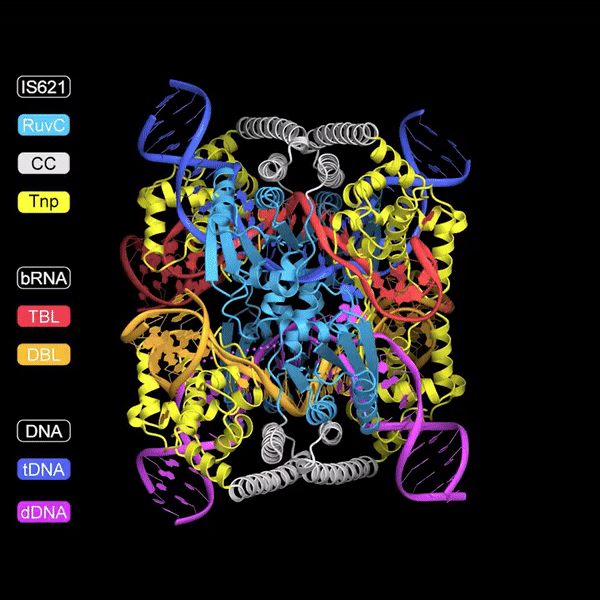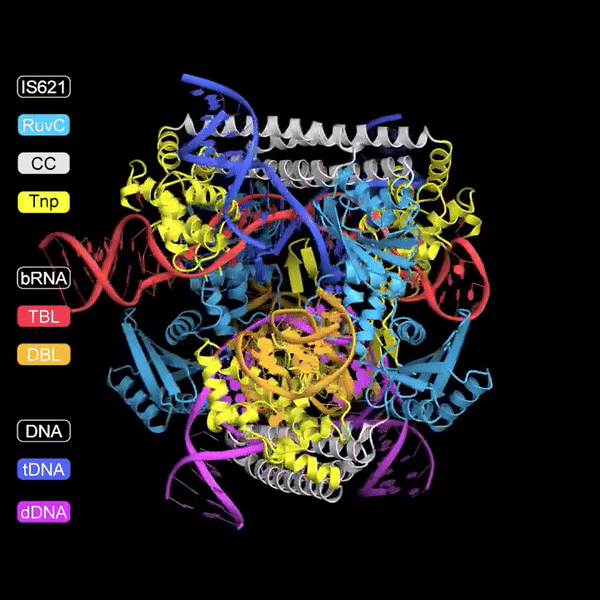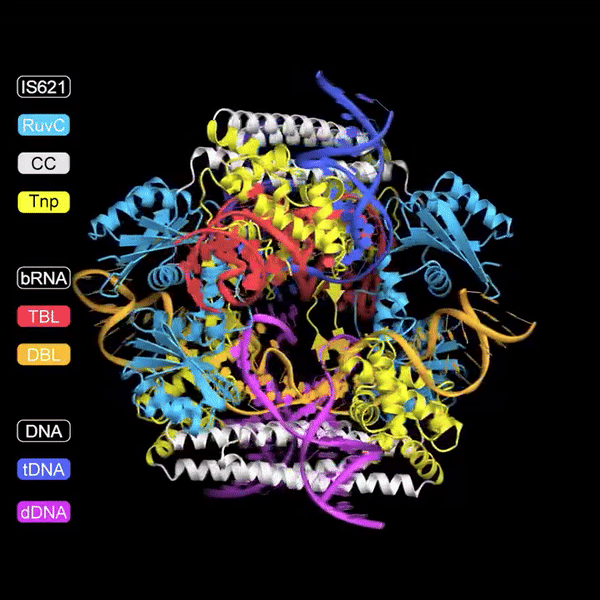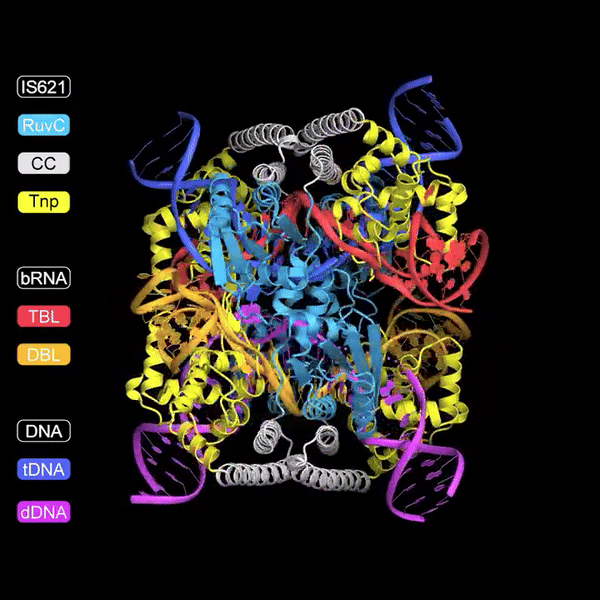
De forma única, este RNA ponte contém duas alças: uma que guia a enzima recombinase até o local alvo no genoma e outra que reconhece o DNA doador.
Uma vez ligado a ambos os substratos de DNA, a recombinase forma sítios ativos compostos para trocar as fitas superiores entre as duas moléculas de DNA.
Após a troca de fitas, o DNA forma um intermediário semelhante a uma junção de Holiday.
Finalmente, as fitas inferiores são trocadas para recombinar totalmente as duas moléculas de DNA sem criar quebras indesejadas no DNA.
As alças do RNA ponte podem ser reprogramadas independentemente para inserir, excisar ou inverter quaisquer dois locais de DNA de interesse, permitindo-nos fazer manipulações genômicas flexíveis além do que é possível com o CRISPR.
Agora, pela primeira vez, o Sistema de Recombinação por RNA Ponte nos dá controle preciso sobre rearranjos de DNA em larga escala, possibilitando uma nova geração de edição e design genômico.
A pesquisa descreve a descoberta de RNAs não codificantes, chamados "Bridge RNAs", que desempenham um papel crucial na mediação da recombinação entre DNA alvo e DNA doador. Esta recombinação é facilitada por elementos genéticos móveis da família IS110, especificamente pelo membro IS621. O estudo demonstra que o ncRNA codificado por IS621 pode formar pares de bases com sequências de DNA alvo e doador, essencialmente "ligando" essas sequências e direcionando a atividade da recombinase, uma enzima que facilita a recombinação de DNA.
Aplicações Potenciais
Edição Genética Precisa: A descoberta abre novas possibilidades para a edição genética, permitindo a inserção ou remoção precisa de segmentos de DNA. Isso pode ser extremamente útil na correção de mutações genéticas causadoras de doenças.
Biotecnologia e Engenharia Genética: Os "Bridge RNAs" podem ser utilizados para modificar geneticamente organismos de maneira controlada, auxiliando na produção de organismos geneticamente modificados (OGMs) com características desejáveis, como maior resistência a pragas ou melhor valor nutricional.
Terapias Gênicas: A capacidade de direcionar recombinações específicas pode ser aproveitada no desenvolvimento de novas terapias gênicas, possibilitando a reparação de genes defeituosos em células humanas.
Pesquisa Básica: Este mecanismo pode ser utilizado como uma ferramenta de pesquisa para estudar a função de genes específicos ao permitir a criação de mutações direcionadas ou a inserção de etiquetas genéticas em locais específicos do genoma.
Os "Bridge RNAs" representam uma evolução significativa na edição de genomas, complementando e expandindo as capacidades do CRISPR, mas não substituindo completamente essa tecnologia.
Comparação entre Bridge RNAs e CRISPR
1. Mecanismo de Ação:
CRISPR-Cas9: Utiliza uma molécula de RNA guia (gRNA) que direciona a enzima Cas9 para um local específico no DNA, onde Cas9 realiza um corte duplo na fita de DNA. Este corte pode ser reparado de maneiras que resultam em edições do genoma, como inserções, deleções ou substituições de bases.
Bridge RNAs: Utilizam um RNA não codificante com duas alças distintas. Uma alça guia a enzima recombinase para o local alvo no genoma, enquanto a outra alça reconhece o DNA doador. Isso permite a recombinação de duas moléculas de DNA sem causar quebras indesejadas no DNA, resultando em rearranjos genômicos precisos e programáveis.
2. Aplicações e Precisão:
CRISPR-Cas9: Extremamente eficiente para introduzir mutações específicas ou pequenas edições no DNA. No entanto, o CRISPR pode ser menos eficiente em rearranjos complexos de grandes segmentos de DNA e pode levar a quebras duplas indesejadas, o que pode resultar em mutações off-target.
Bridge RNAs: Permitem rearranjos complexos, como inserções, deleções e inversões de grandes segmentos de DNA, de maneira mais controlada e sem causar quebras indesejadas. Essa precisão e flexibilidade em manipulações genômicas são vantagens significativas sobre o CRISPR para determinadas aplicações.
Potenciais de Complementaridade
Os Bridge RNAs podem ser vistos como uma ferramenta complementar ao CRISPR, expandindo o arsenal de ferramentas de edição de genomas disponíveis para cientistas. Enquanto o CRISPR é extremamente útil para edições pontuais e correções de pequenas mutações, os Bridge RNAs oferecem uma capacidade aprimorada para rearranjos genômicos mais complexos e controlados. Em conjunto, essas tecnologias podem proporcionar uma gama ainda mais ampla de possibilidades para pesquisa genética, biotecnologia e medicina.
A descoberta dos "Bridge RNAs" é certamente uma inovação importante na biotecnologia e na edição de genomas, mas afirmar que é a maior descoberta da medicina moderna pode ser um exagero. É crucial colocar essa descoberta em contexto com outras inovações significativas na medicina e nas ciências biológicas.
Comparação com Outras Descobertas Importantes
1. Descoberta da Estrutura do DNA (1953):
Impacto: Revelou a base molecular da hereditariedade e abriu caminho para a biologia molecular moderna.
Contribuição: Permitiu o desenvolvimento de técnicas como o PCR, a clonagem de genes e o sequenciamento de DNA.
2. Sequenciamento do Genoma Humano (2003):
Impacto: Forneceu um mapa completo do DNA humano, revolucionando a compreensão das bases genéticas de muitas doenças.
Contribuição: Facilitou o desenvolvimento de medicina personalizada e terapias genéticas.
3. Desenvolvimento do CRISPR-Cas9 (2012):
Impacto: Transformou a edição de genomas, permitindo modificações precisas e eficientes no DNA.
Contribuição: Amplamente utilizado em pesquisa biomédica, agricultura e terapias genéticas.
Próximos Passos na Pesquisa dos Bridge RNAs
A técnica dos Bridge RNAs mostrou-se promissora em testes com bactérias e reações em tubos de ensaio, mas ainda há muito a ser feito antes que possa ser aplicada em humanos. Aqui estão os principais próximos passos para os pesquisadores:
1. Testes em Células Humanas:
Objetivo: Adaptar e testar a técnica dos Bridge RNAs em células humanas.
Desafios: Identificar como a técnica pode ser aplicada eficientemente em um ambiente mais complexo e diversificado como o das células humanas.
Impacto: Se bem-sucedida, a técnica poderia revolucionar a terapia genética, permitindo a inserção e remoção precisas de genes, e a correção de mutações genéticas.
2. Aumentar a Precisão e Eficiência:
Objetivo: Melhorar a precisão e a eficiência da técnica para garantir que as edições genéticas sejam feitas de forma segura e eficaz.
Métodos: Desenvolver métodos para minimizar erros off-target e aumentar a taxa de sucesso das edições desejadas.
Impacto: Garantir que a técnica seja viável para uso clínico, evitando possíveis efeitos colaterais indesejados.
3. Explorar Outras Funcionalidades do Elemento IS110:
Objetivo: Investigar outras possíveis aplicações do elemento IS110 na edição genética.
Métodos: Realizar estudos para entender todas as funcionalidades e potenciais do IS110.
Impacto: Ampliar o leque de aplicações da técnica, potencialmente descobrindo novas maneiras de manipular o genoma.
4. Aplicações Práticas em Terapias Humanas:
Objetivo: Desenvolver aplicações práticas da técnica em terapias celulares para doenças como o câncer e condições hereditárias.
Métodos: Implementar a técnica em estudos pré-clínicos e, eventualmente, ensaios clínicos.
Impacto: Oferecer novas opções de tratamento para uma variedade de doenças genéticas e adquiridas.
5. Parcerias e Desenvolvimento Comercial:
Objetivo: Colaborar com empresas de biotecnologia para acelerar o desenvolvimento e a comercialização da técnica.
Métodos: Trabalhar com startups e empresas estabelecidas, como a Stylus Medicine, para levar a tecnologia do laboratório para o mercado.
Impacto: Facilitar a transição da pesquisa básica para aplicações práticas, tornando a tecnologia amplamente disponível para tratamento médico.
Perspectivas Futuras
Se os pesquisadores conseguirem adaptar com sucesso os Bridge RNAs para uso em células humanas, a técnica tem o potencial de ser ainda mais revolucionária que o CRISPR. Suas vantagens incluem:
Segurança: Redução de quebras indesejadas no DNA, minimizando riscos de mutações off-target.
Precisão: Capacidade de realizar rearranjos complexos de DNA de forma altamente controlada.
Flexibilidade: Potencial para uma ampla gama de aplicações em terapias gênicas e pesquisa genética.
A expectativa é que, com o avanço dessas etapas, os Bridge RNAs possam se tornar uma ferramenta indispensável na medicina moderna, oferecendo novas possibilidades para o tratamento de doenças genéticas e neurodegenerativas.
A descoberta dos "Bridge RNAs" confere ao ser humano um poder significativo na manipulação genética, possibilitando edições precisas e programáveis do DNA em grande escala. Esse poder, como muitas inovações tecnológicas, pode ser usado tanto para o bem quanto para o mal. Vamos explorar ambos os lados.
Uso para o Bem
1. Tratamento de Doenças Genéticas:
Correção de Mutações: Capacidade de corrigir mutações genéticas responsáveis por doenças hereditárias, como fibrose cística, anemia falciforme e distrofia muscular.
Terapias Gênicas: Desenvolvimento de terapias gênicas que substituem genes defeituosos por versões saudáveis, potencialmente curando condições atualmente incuráveis.
2. Avanços na Medicina Personalizada:
Medicina de Precisão: Personalização de tratamentos com base no perfil genético individual, aumentando a eficácia e reduzindo efeitos colaterais.
Terapias Contra o Câncer: Criação de terapias celulares para câncer que podem direcionar especificamente células tumorais, melhorando a eficácia e minimizando danos aos tecidos saudáveis.
3. Combate a Doenças Neurodegenerativas:
Colapso de Mutações Repetitivas: A habilidade de cortar segmentos de DNA poderia ajudar a colapsar mutações repetitivas responsáveis por distúrbios neurodegenerativos como a esclerose lateral amiotrófica (ELA) e a doença de Huntington.
4. Avanços na Biotecnologia e Agricultura:
OGMs Melhorados: Desenvolvimento de organismos geneticamente modificados com características desejáveis, como maior resistência a pragas, melhor valor nutricional e maior rendimento.
Sustentabilidade Ambiental: Criação de plantas que podem crescer em condições ambientais adversas, ajudando a combater a insegurança alimentar e a degradação ambiental (Nature) (Nature).
Uso para o Mal
1. Efeitos Indesejados e Não Intencionais:
Mutagênese Off-Target: Risco de mutações não intencionais que podem causar novas doenças ou agravar condições existentes.
Problemas de Segurança: Falhas na tecnologia podem levar a efeitos adversos imprevistos, colocando pacientes em risco.
2. Bioterrorismo e Armas Biológicas:
Criação de Patógenos: Potencial uso da tecnologia para criar patógenos mais virulentos ou resistentes a tratamentos existentes.
Alterações Genéticas Hostis: Possibilidade de modificar geneticamente populações para reduzir resistência a doenças ou aumentar susceptibilidade a certas condições.
3. Questões Éticas:
Desigualdade Genética: Acesso desigual à tecnologia pode exacerbar desigualdades sociais, criando uma divisão entre os "geneticamente melhorados" e os "não melhorados".
Eugenia: Uso da tecnologia para selecionar características desejáveis, levando a práticas eugenistas e a potenciais abusos de poder.
A tecnologia está mudando rapidamente e as ferramentas estão potencializando as possibilidades humanas como nunca antes. A pergunta que emerge é, as novas descobertas serão usadas para beneficiar a humanidade como um todo, ou serão usadas como arma para subjugar a humanidade? A resposta pode impactar aqueles que estão alheios à realidade e à agenda em execução. Esteja sempre atento às inovações, elas podem ajudar se você souber aproveitar e não cair na manipulação ou no jogo daqueles que estão definindo o mundo.
Este trabalho é importante pra você?
Doe Satoshis: bc1q27ze6w59ytujzvpn7u5ssgsw0hdn90dv7khlxf




















Bridge RNA - A próxima geração da Edição Genética